1. ĐỘ pH
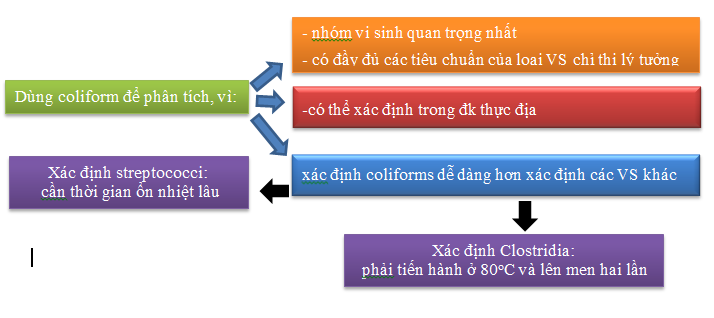
Độ pH còn ảnh hưởng đến cân bằng chuyển dịch giữa các khí độc NH3, H2S (dạng phân tử ) và ion của chúng (NH4+, HS–, S2-). Môi trường quá kiềm gây bất lợi vì dạng NH3 chiếm đa số so với dạng NH4+. Ngược lại, môi trường quá axit cũng gây bất lợi dạng H2S chiếm đa số so với dạng HS–, S2-
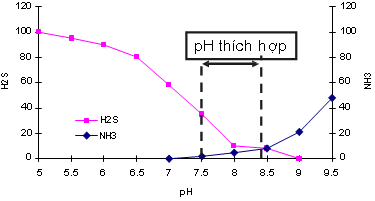
Theo Swingle (1969) thì sự ảnh hưởng của pH nước đến cá nuôi như sau:

Trong các ao giàu dinh dưỡng, thực vật phù du phát triển mạnh:

Biên độ dao động pH càng lớn nếu rong tảo phát triển mạnh và nước có hệ đệm yếu.
+ CO2 từ khí quyển làm giảm pH nếu dung dịch có pH > 4.

2. ĐỘ ĐỤC (Turbidity)
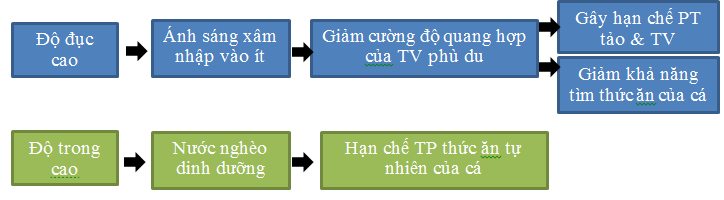
Đơn vị: NTU, FTU. Độ đục đặc trưng cho khả năng nước tán xạ và hấp thu ánh sáng (khả năng ánh sáng chiếu xuyên qua nước) gây ra bởi các hạt lơ lửng như phù sa, các mảnh hữu cơ nhỏ, sinh vật phù du.
3. ĐỘ MÀU
Khái niệm “độ màu” dùng để chỉ màu thực của nước, là màu sau khi lọc bỏ các chất lơ lửng gây đục mẫu nước. Độ màu do các hợp chất hòa tan trong nước gây ra: các muối Fe, Mn, Cu, các chất hữu cơ như axit humic, thuốc nhuộm công nghiệp. Nước tự nhiên có màu nâu vàng nhạt chủ yếu do các chất mùn hấp thu.
Còn màu giả hay màu biểu kiến (apparent) là màu của cả chất hòa tan và chất lơ lửng, sinh vật phù du trong nước gây ra. Bằng cách đông tụ hay lọc, ta có thể loại bỏ được màu giả của dung dịch. Màu giả được xác định trực quan gồm:
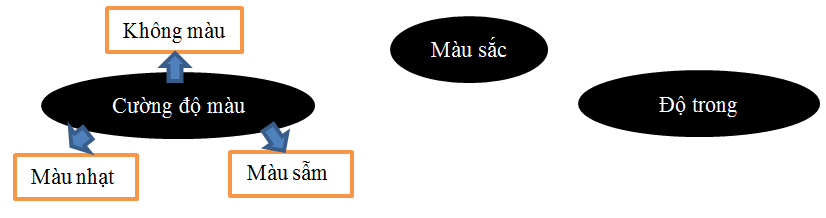
Trong ngành nuôi trồng thủy sản ta chú ý đến màu giả của nước nhiều hơn, vì qua đó có thể đánh giá sơ bộ mật độ sinh vật phù du, môi trường nước giàu hay nghèo dinh dưỡng. Màu nước thích hợp cho các ao nuôi là màu xanh lá chuối non.
4. TỔNG CHẤT RẮN HÒA TAN (TDS)
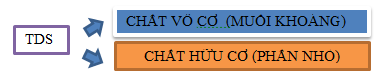
Độ mặn thường dùng trong các ngành trồng trọt, thuỷ sản.
5. TỔNG CHẤT RẮN LƠ LỬNG (TSS) (Cặn không tan)
Các hạt lơ lửng được phân loại dựa vào kích thước:

Các chất lơ lửng có thể mang theo vi sinh vật gây bệnh. Trong xử lý nước, quá trình keo tụ loại bỏ các vật thể lơ lửng che chắn vi sinh vật trước tác động của clo, nhờ đó việc khử trùng bằng clo hiệu quả hơn, giảm tiêu hao hoá chất khử trùng do giảm được nhu cầu clo của nước.
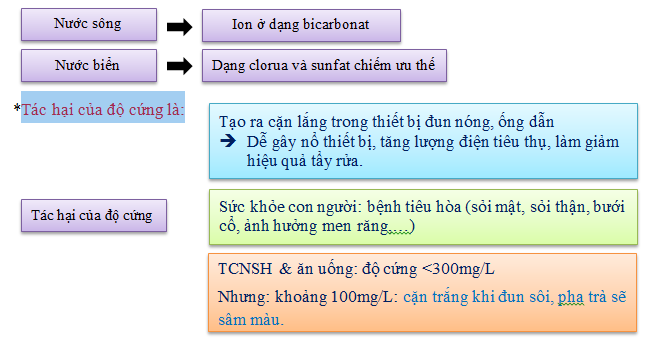
6. ĐỘ CỨNG (Hardness)
Độ cứng để chỉ các ion kim loại hóa trị II, chủ yếu là Ca và Mg, ngoài ra còn có Sr, Ba, Fe, Mn.
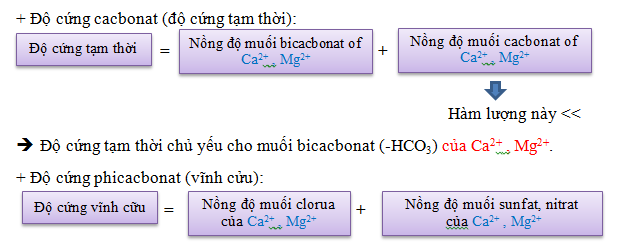
Có thể giảm độ cứng (làm mềm nước) bằng hoá chất, cột trao đổi ion.
Ca (HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O loại bỏ độ cứng do HCO3
CaSO4 + Na2CO3 → Na2SO4 + CaCO3 loại bỏ độ cứng do SO4
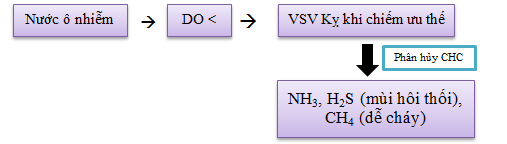
7. OXY HÒA TAN (DO)
Quá trình ôxi hóa các chất hữu cơ sẽ tiêu thụ ôxy hoà tan trong nước (DO).
Trong ao hồ giàu dinh dưỡng, thực vật phát triển mạnh, DO thấp nhất khi gần sáng 3-6h (DO~0 mg/l) và cao nhất là lúc trưa 14-16h (DO~200%).
8. NHU CẦU OXY SINH HỌC (BOD5)
BOD5 là lượng oxi hòa tan bị tiêu thụ bởi vi sinh vật để ôxi hóa các chất hữu cơ và / hoặc chất vô cơ trong 5 ngày ở 20 ± 1oC. Nhu cầu oxygen bao gồm các loại sau:
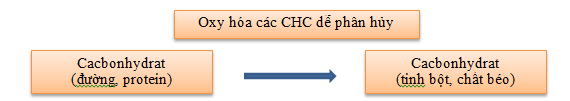
Các chất như cellulose, tannin, lignin, kitin bền vững, khó phân hủy.
Chất hữu cơ trong nước đóng vai trò là thức ăn cho các vi sinh vật dị dưỡng.
VSV hiếu khí tiêu thụ oxy hòa tan trong qt:
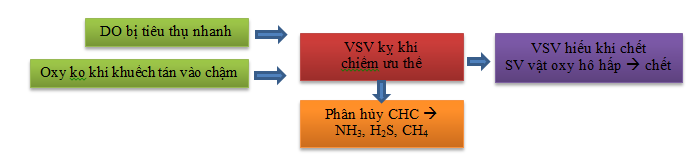
Tốc độ phân huỷ kỵ khí thường chậm và không hoàn toàn.
BOD 5 ngày sẽ tránh được sai số do quá trình nitrat hóa vốn thường xảy ra từ ngày thứ 5 đến ngày thứ 7.
9. NHU CẦU ÔXY HÓA HỌC (COD)
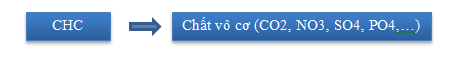
Là lượng oxy cần thiết để oxy hoá các hợp chất vô cơ và hữu cơ trong nước bao gồm ở dạng lơ lửng hay hoà tan.
Trong nước sông không ô nhiễm, chất hữu cơ chủ yếu là axit tannic, axit humic có nguốn gốc từ phân huỷ thực vật tạo nên màu vàng hay nâu của nước.
10. TỔNG SẮT
Trong nước, sắt có thể tồn tại dưới dạng Fe2+ (ferrous), Fe3+ (ferric), các hợp chất hữu cơ hòa tan hay không hòa tan. Còn ion Fe3+ ít di động và ít độc hơn, trầm lắng ở pH>4,5.
Còn ion Fe3+ ít di động và ít độc hơn, trầm lắng ở pH>4,5.
Hàm lượng các muối sắt hòa tan trong nước tỉ lệ nghịch với pH: pH càng cao các muối hòa tan của sắt (II) càng thấp, do đó khi quá trình quang hợp của thực vật phù du trong ao xảy ra mạnh làm pH của nước tăng, sắt trong nước hầu như không có.
11. NHÔM
Nhôm là nguyên tố kim loại phổ biến nhất trong vỏ trái đất, đặc biệt là trong đất phèn, là cation trao đổi chính của đất phèn. Nhôm có nhiều trong nước phèn pH thấp, nồng độ nằm trong khoảng còn bình thường hầu như rất thấp (dạng vết). Nồng độ cao nhất trong nước phèn là 50 mg/l.
12. HYDROGEN SUNFUA (H2S)

Nước chứa H2S thường không gây tác hại cho sức khoẻ nhưng nó làm cho nước có mùi và vị của trứng thối. Nước cấp có chứa hàm lượng H2S thấp khoảng 1,0 ppm đã có đặc tính ăn mòn, làm xỉn màu các đố dùng bằng bạc hay đồng, làm cho quần áo và đồ gốm có vết đen.
H2S là một chất khí cực độc đối với thủy sinh vật, tác dụng độc hại của nó là liên kết với sắt trong thành phần của hemoglobine, không có sắt thì hemoglobine không có khả năng vận chuyển oxy cung cấp cho các tế bào, thủy sinh vật sẽ chết vì thiếu oxy.
Để giảm tác hại của H2S, sục khí tạo môi trường giàu Ôxi để oxy hoá sunfua về sunfat.
14. CÁC DẠNG CỦA NITO
a.Trạng thái tồn tại của Nitơ trong nước thải
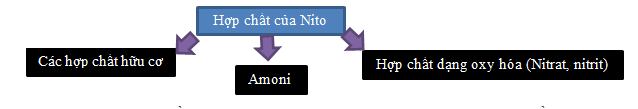
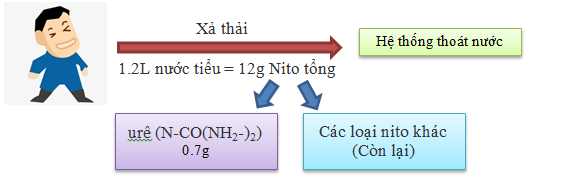
Trong nước thải sinh hoạt: nitơ tồn tại dưới dạng vô cơ (65%) và hữu cơ (35%). Nguồn nitơ chủ yếu là từ nước tiểu.
 b. AMONIUM (NH4)
b. AMONIUM (NH4)
Nó làm giảm tác dụng của clo là tác nhân sát trùng chủ yếu áp dụng ở các nhà máy nước Việt Nam, do phản ứng với clo tạo thành monocloamin là chất sát trùng thứ cấp hiệu quả kém clo hơn 100 lần.
Công nghệ xử lý amoni trong nước ngầm bằng phương pháp sinh học là rất khả thi:
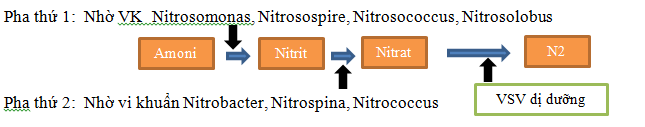
Nitrobacter không có khả năng di động và cần phải bám vào bề mặt giá thể như đá, cát hay một giá thể sinh học nào đó để chúng có thể phát triển thuận lợi nhờ tiết ra chất nhầy từ màng bao bên ngoài.
c. NITRAT (NO3)
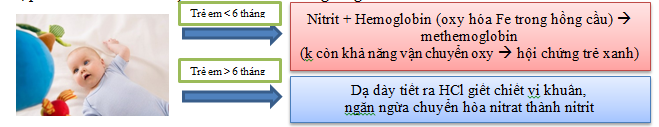
Nitrat không độc đối với thủy sinh vật, là chất dinh dưỡng dễ tiêu đối với thực vật, chúng hấp thu và chuyển hóa thành chất hữu cơ thông qua con đường quang hợp. Tuy nhiên nồng độ nitrat cao, đặc biệt là trong nước giếng, nước sau xử lý sinh học gây tác hại cho sức khỏe. Nước giếng chứa nitrat nhiều hơn nước máy do dễ bị ô nhiễm bởi chất thải, phân bón thẩm thấu qua các mạch nước ngầm gần đó.
- Bùn hoạt tính cũng như màng sinh vật :
Ngoài ra nitrat có thể chuyển thành nitrit kết hợp với aminoacid tạo nitrosoamin là chất gây ung thư.
- Các vi sinh vật dị dưỡng: Sử dụng các chất hữu cơ làm nguồn năng lượng và nguồn cacbon để thực hiện các phản ứng sinh tổng hợp
- Các vi sinh vật tự dưỡng: Có khả năng oxy hoá chất vô cơ để thu năng lượng và sử dụng CO2 làm nguồn cacbon cho quá trình sinh tổng hợp.
- Bùn hoạt tính cũng như màng sinh vật :

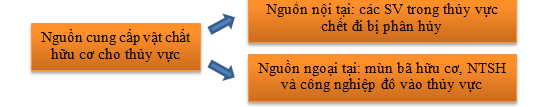
14. PHÚ DƯỠNG HÓA
Quá trình quang hợp:
CO2 + PO4 + NO3 + H2O ==> CH2O,P,N + O2
Biểu hiện phú dưỡng của các hồ đô thị là nồng độ chất dinh dưỡng N, P cao.
Nitrat và phosphat chỉ thị tác động của con người tới môi trường do nước thải sinh họat, công nghiệp (chất bài tiết từ động vật, bột giặt, …) và canh tác nông nghiệp (phân bón).
Các hợp chất vô cơ hòa tan quan trọng của nitơ là NH3, NH4+, NO3– và NO2–.

15. SUNPHAT (SO4)
Sunphat gây các tác động chủ yếu là vấn đề mùi và ăn mòn đường ống.
a) Vấn đề về mùi
Khi không có oxy, sunphat là chất cung cấp oxi (chất nhận điện tử) trong quá trình oxi hoá sinh hoá của vi khuẩn kị khí. Trong điều kiện kị khí, sunphat bị khử thành sunphua.
SO42- + chất hữu cơ 2{ CH2O} vi khuẩn Desulfovibrio H2S + 2H2O + 2CO2

b) Ăn mòn đường ống
Nếu lượng oxi không đủ do quá trình thông gió tự nhiên của không khí trong cống, quá trình khử sunphat thành sunphua sẽ xảy ra. Ở pH thông thường của nước thải, hầu hết sunfua nằm ở dạng H2S và một phần của nó bay vào lớp không khí ở trên lớp nước thải trong cống. Trường hợp thông gió kém, thành và đỉnh cống ẩm ướt, H2S sẽ hoà tan vào lớp nước trên thành và đỉnh cống. Do điều kiện hiếu khí là luôn tồn tại trong hệ thống cống, những vi khuẩn hiếu khí oxi hoá H2S thành H2SO4 và sau đó trở nên đậm đặc và ăn mòn bêton.
2H2S + O2 → 2S + 2H2O
2S + 2H2O + 3O2 → 4H++ 2SO42-
Ăn mòn thành trên ống cống bêton trở nên đáng quan tâm khi nước thải sinh hoạt có nhiệt độ cao, thời gian lưu trong cống dài và nồng độ sulfate cao. Hàm lượng sunfat lớn hơn 300 mg/L có tính xâm thực mạnh trên các công trình xây dựng.
c) Tác động đến con người
Nước cấp có hàm lượng sunfat > 250 mg/L có tính độc hại với con người, vì sunfat có tính nhuận tràng. Sunfat cao, nước sẽ có vị chát và gây bệnh tiêu chảy. Hàm lượng SO42– trong nước cao sẽ gây ảnh hưởng đến con ngươi do tính chất tẩy rửa của sulfate.
16. VI SINH
Trong quan trắc ô nhiễm, thường chúng ta chỉ cần xác định một vài vi sinh chỉ thị cho ô nhiễm phân. Có 3 nhóm vi sinh vật chỉ thị ô nhiễm phân: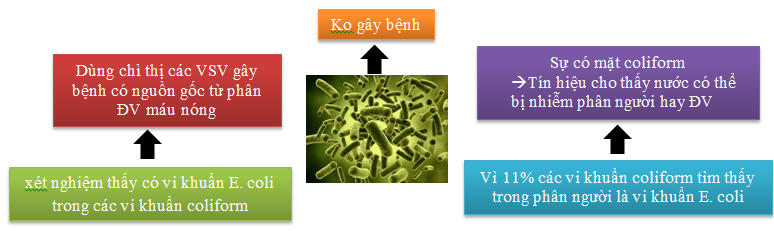
– Nhóm coliform, đặc trưng là Escherichia coli (E.coli)
E.coli thường không có khả năng sinh sản trong nước thải và nước mặt bị ô nhiễm.
Tiêu chảy ra máu là triệu chứng chính của nhiễm E.coli.
– Nhóm Streptococci, đặc trưng là Streptococcus faecalis.
Khi Streptococcus faecalis có trong thức ăn hoặc nước uống, điều đó chứng tỏ nguồn nước hoặc thực phẩm có dấu hiệu nhiễm bẩn liên quan đến nguồn phân người hoặc động vật.
– Nhóm Clostridia khử sulphite, đặc trưng là Clostridium perfringents
Vi khuẩn clostridium là một dạng vi khuẩn gây bệnh tiêu chảy phổ biến và khó phân tích vì: